Semaglutid ve daha yeni çoklu agonistler gibi GLP-1 yolu agonistleri, obezite ve diyabet tedavisinde devrim yarattı, ancak geliştiriciler hâlâ dayanıklılık, doku hedefleme ve sinyal “önyargısı” ile boğuşuyor. Bir peptidin bir kısmını bir halkaya bağlayan makrosiklizasyon, ilaçları bozulmadan koruyabilir ve biyoaktif şekilleri destekleyebilir, ancak geleneksel kimya maliyetli olabilir ve geliştirmenin sonlarında uygulanması zor olabilir.
Sethera Therapeutics ve Utah Üniversitesi Bandarian Laboratuvarı’ndan bir araştırma ekibi, radikal bir enzimin, terapötik peptitleri, olağan lider dizi gereklilikleri olmadan kompakt halkalara “bağlayabildiğini” gösterdi.
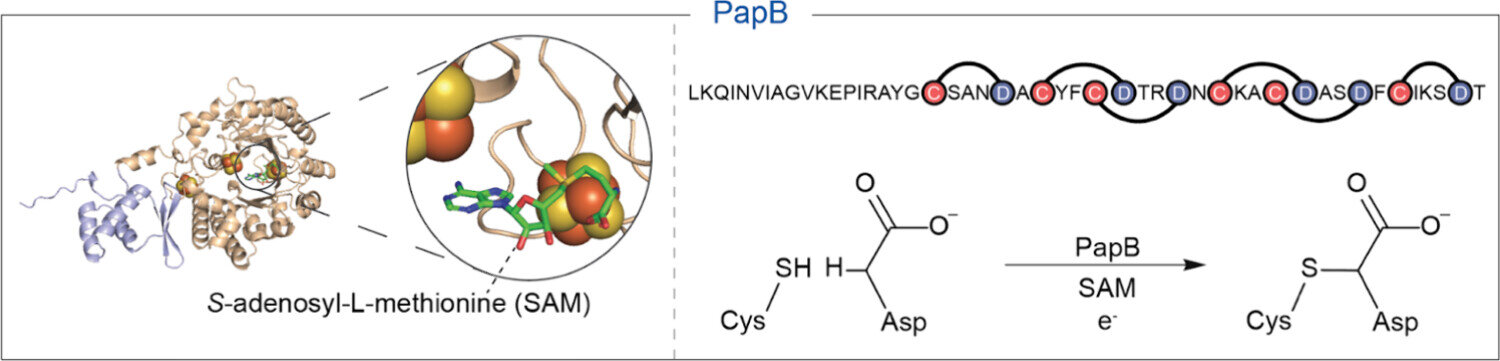
Dergide yeni yayınlanan bir çalışmaACS Bio ve Med Kimya Au biyokatalitik bir kısayolu rapor ediyor: peptit C terminalinde, birçok peptit değiştirici enzimin genellikle ihtiyaç duyduğu lider etiketleri olmadan kesin bir tiyoeter bağı diken bir enzim. Analitik okumalarda, GLP-1 benzeri analoglar, enzimatik işlemden sonra halka oluşumunu gösteren ayırt edici değişiklikler sergiledi.
Çalışma, RiPP (ribozomal olarak sentezlenmiş ve translasyon sonrası değiştirilmiş peptit) ailesinden radikal S-adenosil-L-metiyonin (rSAM) maturazlarına odaklanmaktadır. RiPP enzimleri tipik olarak spesifik bağlanma için bir RRE (RiPP tanıma elemanı) aracılığıyla bir N-terminal “lider” dizisini tanır.
Burada ekip “liderden bağımsız” aktivite gösterdi: prosesleri temiz bir şekilde makrosiklik hale getirilmiş GLP-1 yolu analogları, bir C-terminali çapraz bağlama motifi ile tasarlandı ve doğrusal peptitleri ılımlı koşullar altında değiştirdi. Enzim, pazarlanan inkretinlerde ortak olan kanonik olmayan kalıntıları içeren substratlarda bile bunu yaptı ve geniş toleransın altını çizdi.
Makalenin başyazarı Jake Pedigo, “Bir tezgah perspektifinden bakıldığında, sürpriz olan, enzimi ne kadar ileri götürebildiğimiz (yerel lider yok, değişen liderler, kanonik olmayan kalıntılar) ve yine de temiz, tek halkalı ürünler görebildiğimizdi. Tolerans ve kontrolün bu birleşimi, PapB’yi sadece harika bir mekanizma değil, pratik bir araç gibi hissettiriyor” diyor makalenin baş yazarı Jake Pedigo.
Enzimoloji açısından çalışma, mekanik olarak spesifik ancak çarpıcı biçimde substrat açısından karışık olan alışılmadık bir çizgide yer alıyor. RiPP maturazlarının çoğu lider/RRE etkileşimlerine ihtiyaç duyarken, Sethera ve Utah Üniversitesi grubu ilgisiz bir lider taşıyan kimerik bir substratı değiştirdi ve RRE alanı silindiğinde hala aktivite gösterdi; bu da ne kanonik lider bağlanmasının ne de sağlam RRE’nin kesinlikle gerekli olmadığını gösteriyor.
Bu minimum kısıtlamanın, siklizasyon sahasındaki yerel bir Cys-Xⁿ-Asp/Glu motifine indirgendiği ve çok az yeniden mühendislik ile “tak ve çalıştır” makrosikl kurulumuna olanak sağladığı görülmektedir.
Terapötik açıdan C-terminal halkası, zinciri bağlamaktan daha fazlasını yapabilir. Kuyruğu sertleştirerek reseptör afinitesini veya önyargı sinyalini artırabilir; C terminalini kapatarak proteazları bloke edebilir; ve enzimatik süreç farklı dizileri kabul ettiğinden, halkanın kendisi, albümin, taşıyıcılar veya hastalıkla ilgili reseptörleri (daha uzun yarı ömür, doku hedefleme veya seçici aktiviteye giden yollar) bağlamak için modüler bir “tutamaç” olarak tasarlanabilir. Birlikte, bu veriler yeni nesil inkretinlere ve diğer peptit ilaçlara giden genel, geç aşamalı bir biyokatalitik yol önermektedir.
“Büyük ilaç şirketlerinin GLP-1 omurgaları zaten mükemmel; eklediğimiz şey, C terminalini ‘bağlayabilen’ ve bu moleküllerin daha da sıkı çalışmasını sağlayan temiz, son aşamadaki bir enzimatik adımdır. Lider etiketleri olmayan hassas bir tiyoeter halkası yerleştirerek, günümüz dünyasında kullanılan kanonik olmayan kalıntılarla uyumlu kalarak yarılanma ömrünü, stabiliteyi ve hatta reseptör sinyalleme yanlılığını veya doku hedeflemeyi ayarlayabiliriz. inkretinler.
Sethera Therapeutics CEO’su Karsten Eastman, “Pratik anlamda bu, kanıtlanmış iskelelerde daha hızlı yineleme ve farklılaştırılmış, yeni nesil GLP-1 ve çoklu agonist ilaçlara yönelik daha net bir yol anlamına geliyor” diyor.