Biyolojide enzimler, kimyasal reaksiyonları yönlendirmek için milyonlarca yıl boyunca gelişmiştir. Max Planck Dinamik ve Kendini Organizasyon Enstitüsü’nden (MPI-DS) bilim adamları, optimal enzimlerin de novo tasarımını sağlamak için evrensel kurallar elde ettiler.
Makale dergide yayınlandı Kimya katalizi.
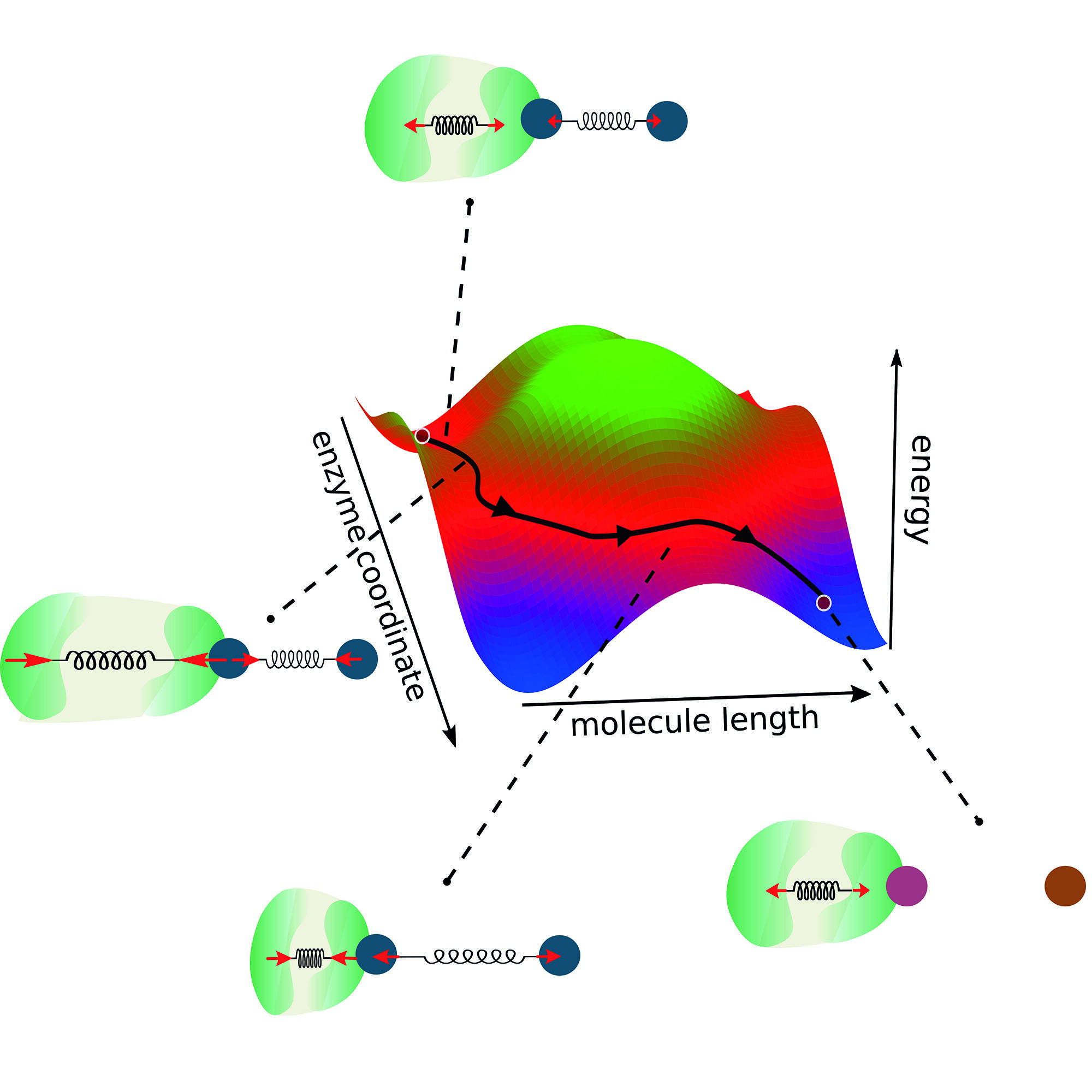
Örnek olarak, bir dimeri iki monomer molekülüne ayırmanın enzimatik reaksiyonunu düşündüler. Böyle bir enzim-substrat-kompleksinin geometrisi göz önüne alındığında, fonksiyonel bir enzim oluşturmak için düşünülmesi gereken üç altın kural belirlediler.
İlk olarak, hem enzimin hem de molekülün arayüzü kendi küçük uçlarında bulunmalıdır. Bu şekilde, her ikisi arasında güçlü bir bağlantı elde edilebilir. Aynı nedenle, enzimdeki konformasyonel değişiklik reaksiyondan daha küçük olmamalıdır. Son olarak, enzimin konformasyonel değişimi, reaksiyonun kimyasal itici kuvvetini en üst düzeye çıkaracak kadar hızlı gerçekleşmelidir.
MPI-DS direktörü Ramin Golestanian yaklaşımı açıklıyor.
“Reaksiyon koordinatları arasında momentumun korunması ve bağlantısı,” diye devam ediyor.
Böylece, araştırmacılar klasik 2 boyutlu reaksiyon koordinatının görüşünü genişletti. Tipik olarak, enzimatik reaksiyon modelleri, reaksiyonun gerçekleşmesi için aşılması gereken bir enerji bariyerini tanımlar.
Çalışmanın ilk yazarı Michalis Chatzittofi, “Modelimizde olduğu gibi, enzim dinamikleri ve birleştirmeyi de düşünüyoruz, iki reaksiyon koordinatı göz önüne alındığında, mevcut kavramın ötesine geçiyoruz.”
“Bir enerji bariyerinin üstesinden gelmek yerine, şimdi alternatif rotalar alarak onu atlamanın alternatif yollarını hayal edebilirsiniz.”
Bu sonuçlar, her bir atomun dinamiklerini ayrı ayrı simüle etmek için sıkıcı ve teknik olarak zorlu yaklaşımdan kaçınarak moleküler makinelerin tasarımı için yeni bir temel sağlar.