En son teknolojiye sahip yapay zeka programları, proteinlerin küçük moleküllerle nasıl etkileşime girdiğini tahmin ederek ilaçların geliştirilmesini destekleyebilir. Ancak Basel Üniversitesi’ndeki araştırmacıların yeni bir çalışması yayınlandı. Doğa İletişimi Bu programların fiziksel ilişkileri anlamak yerine yalnızca kalıpları ezberlediğini gösterdi. Yenilikçi ilaçlar için özellikle ilgi çekici olacak yeni proteinler söz konusu olduğunda sıklıkla başarısız oluyorlar.
Proteinler sadece vücutta değil tıpta da önemli bir rol oynarlar: ya enzimler ya da antikorlar gibi aktif bileşenler olarak hizmet ederler ya da ilaçlar için hedef yapılardırlar. Bu nedenle yeni tedaviler geliştirmenin ilk adımı genellikle proteinlerin üç boyutlu yapısını çözmektir.
Uzun bir süre boyunca protein yapılarını açıklamak oldukça karmaşık bir çabaydı, ta ki makine öğrenimi protein araştırmalarına girene kadar. AlphaFold veya RosettaFold gibi adlara sahip yapay zeka modelleri yeni bir çağ başlattı: Amino asitler olarak bilinen protein yapı taşları zincirinin üç boyutlu bir yapıya nasıl katlandığını hesaplıyorlar. 2024 yılında bu programların geliştiricileri Nobel Kimya Ödülü’nü aldı.
Şüphe uyandıracak kadar yüksek başarı oranı
Bu programların en son versiyonları bir adım daha ileri gidiyor: Söz konusu proteinin başka bir molekülle (uzmanların deyimiyle kenetlenme ortağı veya ligand) nasıl etkileşime girdiğini hesaplıyorlar. Bu örneğin aktif bir farmasötik içerik olabilir.
Basel Üniversitesi’nden Profesör Markus Lill, “Proteinlerin yapısını bir ligandla birlikte tahmin etme olasılığı, ilaç geliştirme açısından paha biçilemez” diyor. Farmasötik Bilimler Bölümü’ndeki ekibiyle birlikte aktif farmasötik bileşenlerin tasarlanmasına yönelik yöntemler araştırmaktadır.
Ancak yapısal tahminin görünüşteki yüksek başarı oranları Lill ve ekibinin kafasını karıştırdı. Özellikle, yapay zeka modellerini eğitmek için ligandlarıyla birlikte halihazırda açıklanmış yalnızca 100.000 kadar protein yapısı mevcut olduğundan, bu sayı, yapay zeka için diğer eğitim veri kümeleriyle karşılaştırıldığında nispeten azdır. Lill, “Bu yapay zeka modellerinin, eğitim verilerini kullanarak fiziksel kimyanın temellerini gerçekten öğrenip öğrenmediğini ve bunları doğru şekilde uygulayıp uygulamadığını öğrenmek istedik” diyor.
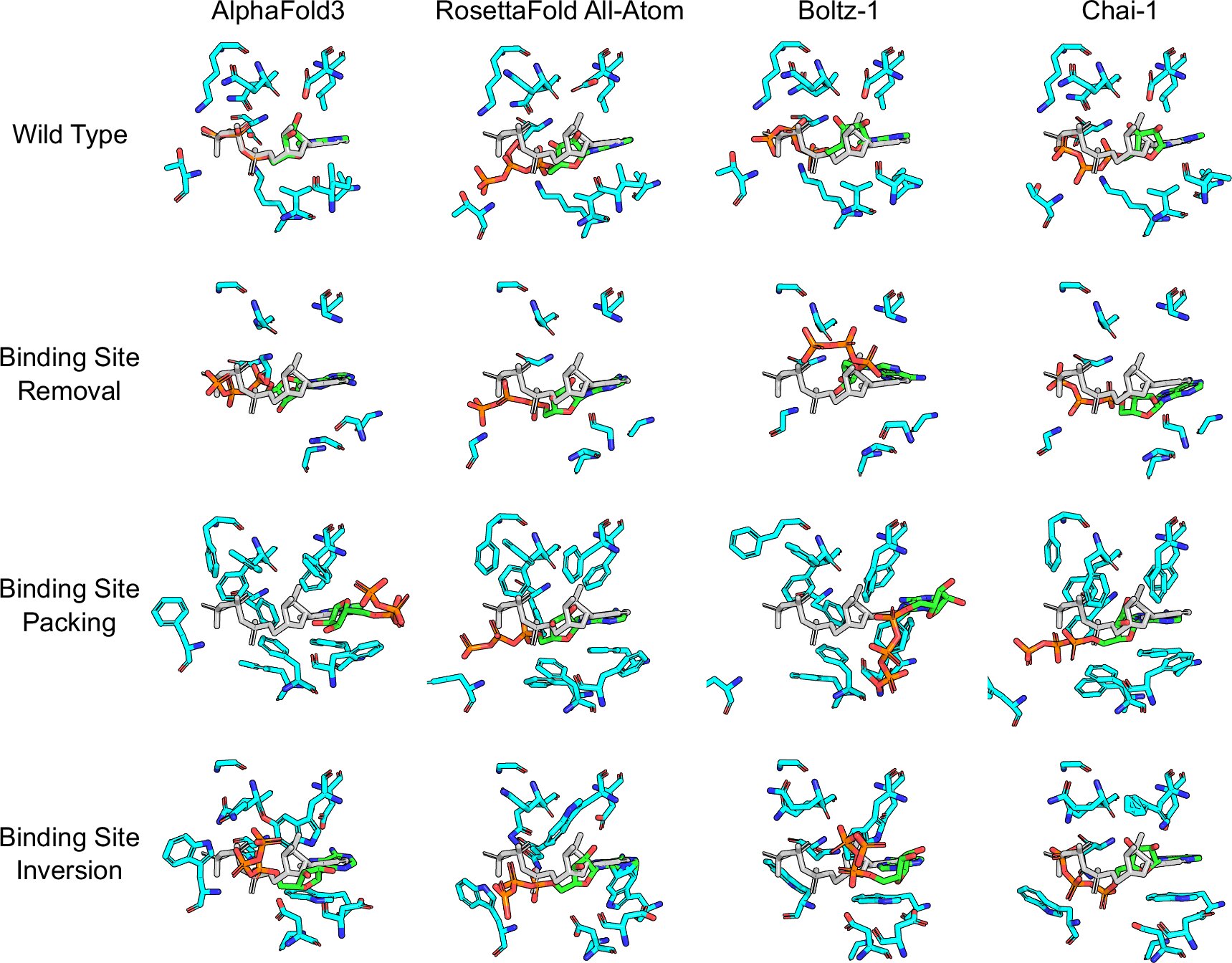
Önemli ölçüde değiştirilmiş bağlanma bölgeleri için aynı tahmin
Araştırmacılar yüzlerce örnek proteinin amino asit dizisini, ligandlarının bağlanma bölgelerinin tamamen farklı bir yük dağılımı sergileyeceği veya hatta tamamen bloke edileceği şekilde değiştirdiler. Bununla birlikte yapay zeka modelleri, sanki bağlanma hâlâ mümkünmüş gibi, aynı karmaşık yapıyı tahmin ediyordu. Araştırmacılar ligandlar için de benzer bir yaklaşım izlediler: Ligandları artık söz konusu proteine bağlanamayacak şekilde değiştirdiler. Bu da yapay zeka modellerini rahatsız etmedi.
Vakaların yarısından fazlasında modeller, amino asit dizisindeki müdahaleler hiç meydana gelmemiş gibi yapıyı tahmin etti. Lill, “Bu bize, en gelişmiş yapay zeka modellerinin bile bir ilacın bir proteine neden bağlandığını gerçekten anlamadığını gösteriyor; yalnızca daha önce gördükleri kalıpları tanıyorlar” diyor.
Bilinmeyen proteinler özellikle zordur
Proteinlerin eğitim veri setleriyle herhangi bir benzerlik göstermemesi durumunda AI modelleri belirli zorluklarla karşı karşıya kaldı. Lill, “Tamamen yeni bir şey gördüklerinde hemen yetersiz kalıyorlar, ancak yeni ilaçların anahtarı tam da burada yatıyor” diye vurguluyor.
Bu nedenle ilaç geliştirme söz konusu olduğunda AI modellerine dikkatle bakılmalıdır. Fizikokimyasal özellikleri gerçekten hesaba katan deneyler veya bilgisayar destekli analizler kullanarak modellerin tahminlerini doğrulamak önemlidir. Araştırmacılar, çalışmaları sırasında yapay zeka modellerinin sonuçlarını incelemek için de bu yöntemleri kullandılar.
Lill, “Daha iyi çözüm, fizikokimyasal yasaları gelecekteki yapay zeka modellerine entegre etmek olacaktır” diyor. Daha gerçekçi yapısal tahminleri sayesinde bunlar, yeni ilaçların, özellikle de şu ana kadar açıklanması zor olan protein yapılarının geliştirilmesi için daha iyi bir temel sağlayabilir ve tamamen yeni terapötik yaklaşımların olasılığını açabilir.