İlaç keşfi uzun ve karmaşık bir süreç olabilir. Hayvan modeli sonuçlarının insanlarda etkinliği öngördüğü kanıtlanmadığından, Alzheimer hastalığı gibi nörodejeneratif hastalıklar için ilaçlar geliştirilmesi en pahalı olanlar arasındadır. Bilim adamları genellikle tek bir potansiyel yeni ilacı tanımlamadan önce birçok biyolojik hedefi taramak zorundadırlar.
Carnegie Mellon Üniversitesi’ndeki araştırmacılar, yüksek verimli ilaç taramasını mümkün kılmak için bir platform geliştiriyorlar. Çalışmaları, ilaç keşif sürecinin her bir parçasını optimize etme çabalarının bir parçasıdır ve hastaları tedavi etme yarışındaki gerçek etkilerdir.
Anne Skaja Robinson, hücrenin yüzeyinde bulunan proteinleri olan G-Protein bağlantılı reseptörleri (GPCR’ler) araştırır. Diyabet, alerji ve kanser tedavileri de dahil olmak üzere birçok küçük moleküllü ilacın hedefidir. Robinson laboratuvarı bu transmembran proteinlerinin ve bunların akış aşağı hücresel tepkilerinin rolüne odaklanmıştır. Bir GPCR’nin bir tarafı hücreye bakar, burada bir G-protein ile ilişkilidir. Bir GPCR’nin diğer tarafı, bir ilacın bağlanabileceği hücrenin dışındadır; Böylece, bir hücrenin ortamı için sensörler olarak hizmet ederler.
Sarah Sonbati, “Çok fazla kullanılmayan terapötik potansiyel var” diyor. Bilinen 800 GPCR vardır, ancak mevcut ilaçlar bunların% 15’inden daha azını hedeflemektedir.
Hastalık tedavilerindeki boşluk mevcuttur çünkü bilim adamları henüz bazı GPCR’lere neyin bağlandığını henüz bilmiyorlar. Bu yetim GPCR’leri (OGPCR’ler) aktive etmek için küçük moleküllerin tanımlanması olası yeni ilaçların bir yoludur.
Alzheimer hastalığı özellikle ilgi çekicidir, çünkü bilim adamları hastalığı olan kişilerde belirli GPCR’lerin yukarı regülasyonu veya artış olduğunu bilirler. Henüz tedavi yok. “Ya Alzheimer hastalığının temel nedenine bakmaya başlarsak ve bunu hedeflemeye çalışırsak?” Bir Kimya Mühendisliği Ph.D. öğrenci. “Cevap GPCR’lerde ve bir GPCR’nin nasıl etkinleştirildiğini anlamak olabilir.”
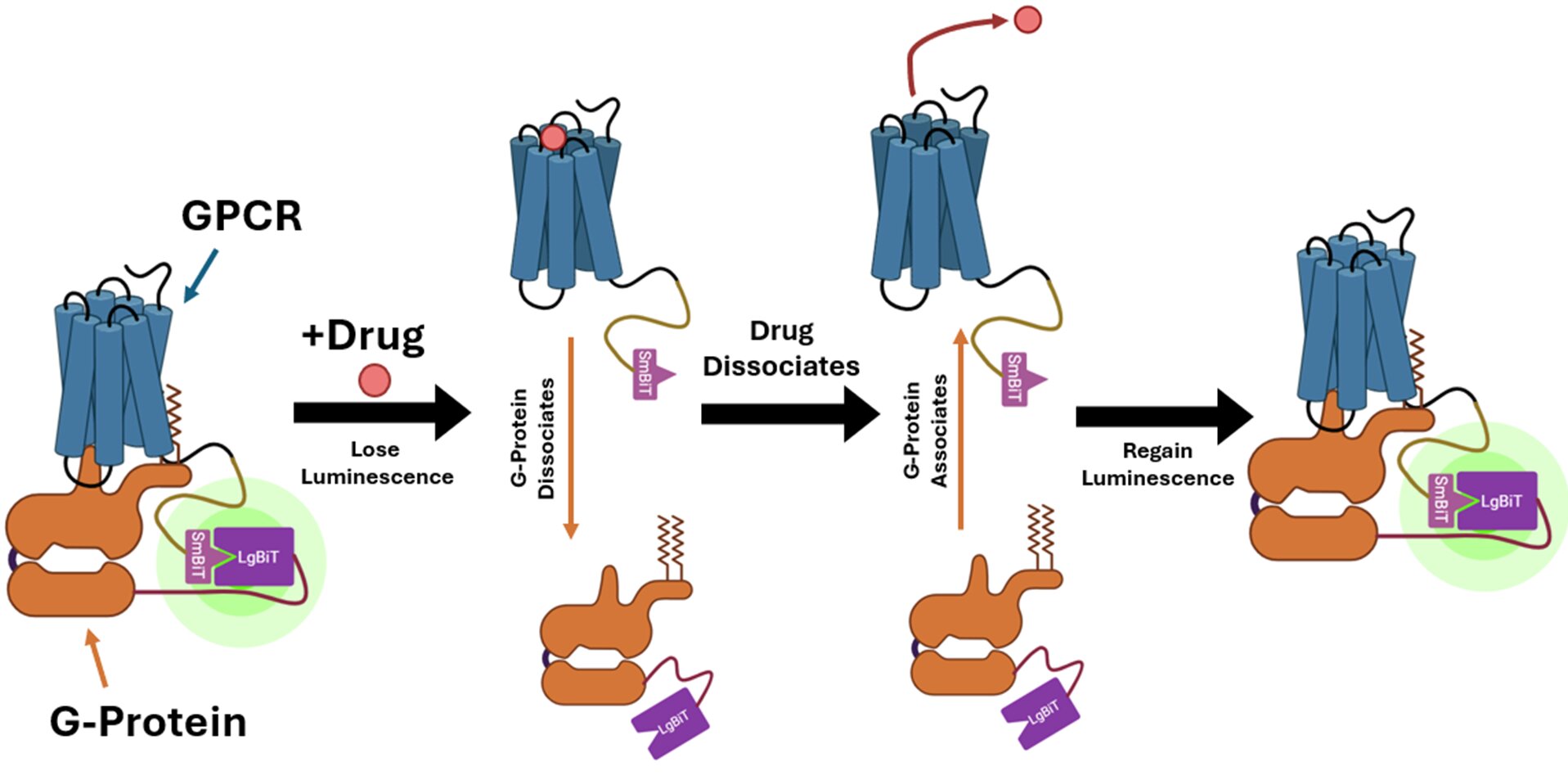
Bir ilaç hücre zarının dışındaki GPCR ile birleştiğinde, hücre içindeki G-protein ayrılır. Sonbati, GPCR’lerin ve G-proteinin bağlanmasını tespit etmek için biyosensör kullanan bir biyosensör oluşturmak için ilişkideki bu değişiklikten yararlandı.
Kimya Mühendisliği Profesörü Robinson, “Platformumuz protein aktivasyonunun kendisinin ve hücresel bir bağlamda daha spesifik tespit edilmesini sağlıyor” diyor. Robinson ve Sonbati, hücre bazlı testlerini, ateş böcekleri tarafından yayılan ışığa dayanarak geçici lüminesans sağlamak için özel olarak tasarlanmış bir enzim kullanan mevcut bir sistemden geliştirdiler. Enzim lusiferaz, her biri bir proteine bağlı küçük bir bit ve büyük bir bit içine bölünür. İki protein etkileşime girdiğinde, lusiferaz bitleri fonksiyonu ve parıltıyı yeniden oluşturacak kadar yakındır.
Sonbati, Robinson laboratuvarının kapsamlı bir şekilde çalıştığı bir GPCR kullanarak yaklaşımı optimize etti.2a reseptör. Sonbati, “İyi karakterize edilmiş bir sistemde verilerin nasıl göründüğünü anlamamız, o bilinmeyen yetim GPCR alanlarına girmeden önce bize hücredeki etkileşimler hakkında ne söylediğini anlamamız gerekiyordu” diyor Sonbati.
Aktive eden ilaçlar2a bilinir. Sonbati iki ilaç sınıfına baktı: reseptör aktivitesini yukarı regüle eden agonistler; ve reseptör aktivitesini aşağı regüle eden ters agonistler. Başlangıçta, a2a G-protein ile zaten bağlı veya “önceden bağlanmış”, hücredeki bir dinlenme durumunda bile biyolüminesans oluşturur. Bir agonist eklendiğinde, GPCR ve G-Protein ayrılmalı ve sensör artık lüminesans göstermemelidir. Sonbati’nin sonuçları bu davranışı kontrol proteinden doğruladı.
Ters bir agonist eklendiğinde, G-Protein GPCR’ye geri alınır ve lüminesans tekrar artar. Sonbati, “Bu sonuçlar her zaman lüminesansta bir azalma görmeyi beklemediğimizi anlamamıza yardımcı oldu. İlk duruma kıyasla değişiklikler arıyoruz, bu da bize sensörümüz hakkında daha fazla bilgi verecek” diyor Sonbati.
Hücre tipi, yoğunluk ve transfeksiyon yöntemleri için optimize edildikten sonra, Sonbati platformu Alzheimer hastalığında yukarı regüle edilen iki yetim GPCR’ye başarıyla uyguladı. “Kimse daha önce onlara bu şekilde bakamadı” diyor.
Sensör ayrıca, yetim GPCR’lerin her ikisinin de G-proteine önceden bağlandığını,2a . Hücredeki fonksiyonları etkileşim kurmak veya etkinleştirmek için başka bir molekül gerektirmezler. “Bu, lüminesans hakkında öğrendiğimiz her şey2a Bu alanda uygulanabilir “diyor Sonbati.
Robinson laboratuvarı, herhangi biriyle birlikte çalıştıkları yetim GPCR’leri etkinleştirip etkinleştirmediğini görmek için Ulusal Sağlık Enstitüleri’nden (NIH) 700-Trug Kütüphanesi test ediyor. Sonbati ayrıca platformlarını memeli hücrelerinden mayaya geçmek için yapılar tasarladı. Maya daha hızlı büyür ve daha sağlamdır, daha fazla deney ve daha hızlı sonuçlar sağlar.
Robinson ve Sonbati’nin platformu, GPCR aktivasyonunu test etmek ve anlamak için güçlü bir araçtır. Geleneksel yöntemlerden daha hızlı ve daha ucuzdur.
Sonbati, “Vizyonumuz bunu daha genel olarak yüksek verimli ilaç taraması için uygulamaktır” diyor. “Her küçük kuyuda sensörümüzle iyi bir plaka hayal edin. Her kuyuya farklı bir potansiyel ilaç eklersiniz. Tüm kuyular parlamaya başlar, yani proteinler bir tane hariç etkileşime girer. Bu kuyudaki ilaç daha fazla bakmak istediğiniz ilaçtır.”
Bu araçları gelişmekte olan makine öğrenme teknolojileri ile birleştirerek Robinson ve Sonbati, Alzheimer hastalığı ve tedavi için daha az izlenebilir diğer hastalıklar için ilaç hedefleri için yeni yollar açmayı umuyor.