Singapur Teknoloji ve Tasarım Üniversitesi’nden (SUTD) araştırmacılar, hücre içi iletimi kolaylaştırmak için mekanik olarak deforme olmak için yeni bir yöntem geliştirmek için mikroakışkanlar alanındaki uzmanlıklarından yararlandı ve hücresel düzeyde kişiselleştirilmiş tedavileri devrim yarattı.
Tıbbi araştırmalar son yıllarda inanılmaz adımlar attı ve bilim adamları hücresel düzeyde yeni bilgiler ortaya çıkarıyorlar. Bu daha derin anlayış, bir zamanlar tedavi edilemez olduğu düşünülen koşullar için daha küçük, daha kişiselleştirilmiş tedavilere yol açmıştır. Genetik durumlar ve hücresel tepkiler hakkında artan bilgi ile, önemli miktarda araştırma, bunları temel düzeyde etkili bir şekilde değiştirmeye odaklanmıştır.
Gelişmiş tedavilerin, özellikle hücresel düzeyde gerçekleştirilen tedavilerin çalışması için, terapötik ajanlar doğrudan hedef hücrelere verilmelidir. Bununla birlikte, hücreler istenmeyen maddeleri engelleyen membranlara sahiptir ve etkili tedavi iletimi için önemli bir engel oluşturur. Bunun üstesinden gelmek için iki ana yaklaşım vardır. Birincisi, ajanları hücre zarlarından getirmeye yardımcı olmak için taşıyıcıları kullanmaktır, ikincisi ise girişe izin vermek için zarda geçici delikler (geçici nanoporlar olarak bilinir) oluşturmaktır.
SUTD’den Doçent Ai Ye, “Önceki araştırmalar, hücrelerin hızlı deformasyonunun ve hücrelerin iyileşmesinin hücre içi doğum için yüksek verimliliğin sağlanmasının anahtarı olduğunu söylüyor.” Dedi.
Bununla birlikte, elektroporasyon ve lipofeksiyon gibi her iki yaklaşımı kullanan mevcut yöntemler ya geri dönüşü olmayan hücre hasarı yaratabilir veya yüksek toksisiteye neden olabilir. Terapötik ajanların hedef hücrelere verilmesini kolaylaştırmak için uygun bir yöntem olmadan, CAR-T tedavisi ve gen düzenleme gibi yeni terapötik teknikler çoğunlukla uygulamalarında kısıtlanmıştır.
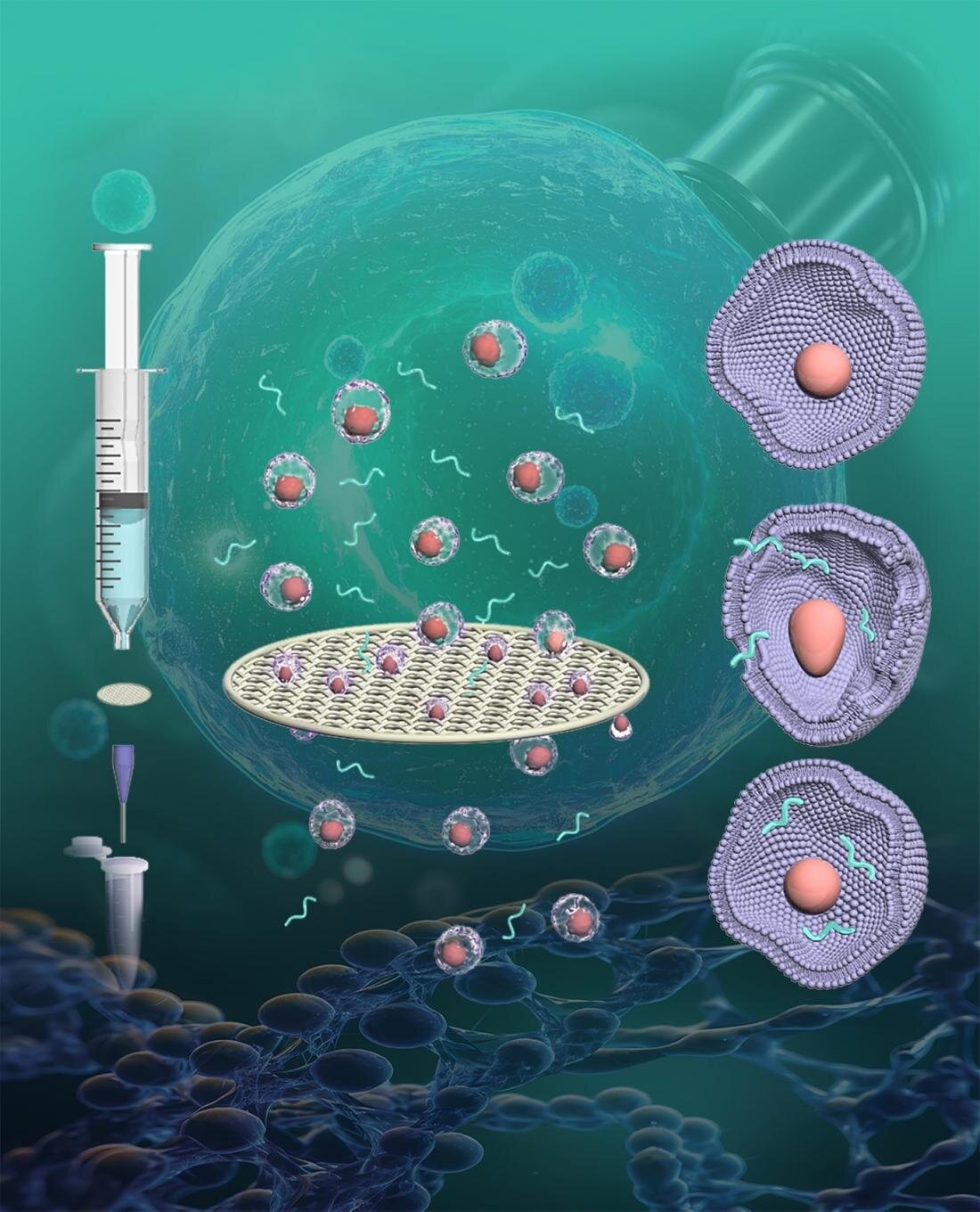
MicroCluidic Technology kullanarak tek hücreli deformasyondaki uzmanlıklarına dokunma, Doç. AI ve ekibi, mekanik olarak geçici nanoporlar oluşturmak için paslanmaz çelik filtreler ve viskoelastik sıvıların kullanımını araştırdı.
Makalede hücre içi teslimat üzerine araştırmalarda yeni kapılar açabilen yeni bir teknik önerdiler, “paslanmaz çelik filtreler ve viskoelastik sıvılarla gelişmiş hücre içi iletim: geleneksel transfeksiyona yüksek verimli bir alternatif” Analitik kimya.
Doç. AI, başlangıçta, hücre içi iletimi mümkün kılmak için mikro-inşaatları mikro-inşaatlarda ve viskoelastik sıvılarda kullanmayı planladı-önceki araştırmalarda kullandığı bir teknik. SUTD Girişimciler için Hızlandırıcı Araştırma ve İnovasyon (Arama) programında diğer araştırma gruplarına ve şirketlere danıştıktan sonra, verimi iyileştirmek için mikroakışkan çipin yerini alması gerektiğini fark etti.
Bu, geleneksel mikroakışkan cihazlarda kullanılan silikon bazlı gofretler yerine paslanmaz çelik filtreler kullanma fikrine yol açtı. Paslanmaz çelik filtreler, potansiyel tıkanmayı önlemeye yardımcı olan ve böylece hücre ölümü olasılığını en aza indiren ortalama hücre çapından daha büyük açıklıklara sahiptir.
Çalışmada, paslanmaz çelik filtreler, viskoelastik sıvıların hücreler üzerinde mekanik olarak deforme ve geçici nanoporları deforme etmek için kuvvet uyguladığı sürekli olarak büyüklüğünde açıklıklar sağlamak için bir şablon görevi gördü. Ekibin prototipinin bir testi, bu yöntemin%94.7’ye kadar yüksek doğum verimliliği sağlayabileceğini ve aynı zamanda hücrelerin hala yaşayabilir olmasını sağlayabileceğini gösterdi.
Doç. Prof. AI, bunun birkaç mikrosaniye aralığında olan deformasyonun hızı nedeniyle elde edilebileceğini açıkladı. “Böyle küçük bir deformasyon süresi, hücre zarlarında hızlı üretim nanoporları ve hızlı hücre içi-dışsalüler hacim değişimini sağlar.” Dedi. “Bu nedenle, özellikle elektroporasyonla karşılaştırıldığında hücrelere verilen hasar azalır.”
Sonuçlar umut verici olsa da, Doç. AI, daha fazla iş yapılması gerektiğine inanmaktadır. Diyerek şöyle devam etti: “Bu yöntemin evrenselliğini kanıtlamak için daha fazla hücreyi test etmemiz gerekiyor, ki bu hala çok daha fazla çabaya ihtiyaç duyuyor.”
Buna ek olarak, ekibi, mikrofabrikasyon yeteneklerine sahip olmayabilecek ticari laboratuvarlar için daha erişilebilir olacak bağımsız bir prototip oluşturmayı planlıyor. Genel, Doç. Prof. AI, ekibinin tekniğinin hücresel mühendislik araştırmalarını ilerletme potansiyeli konusunda iyimser.
“Bu teknolojinin araştırmacıların CAR-T terapisi ve gen düzenlemesinin iyileştirilmesine katılmaları için gereksinimleri azaltabileceğini umuyoruz.” Diyerek şöyle devam etti: “Bu teknolojinin hücre mühendisliği sürecini basitleştirebilecek yüksek evrenselliğe ve tekdüzeliğe sahip olduğuna inanıyoruz.”